|
Após a
etapa acima, os fragmentos de tecido serão incluídos em resina epox
levados à estufa para a polimerização (Silva et al., 2000)
Após aparar os blocos para retirada do excesso de resina, deve-se fazer
cortes semifinos, com espessura de 300 nm, com auxílio do ultramicrótomo
(Reichert - Ultracuts S/FC S). Esses cortes serão colocados em lâmina e
corados com azul de toluidina a 1% para possibilitar a identificação da
área que será utilizada para a contagem sináptica. A partir da
identificação da área desejada, os blocos serão aparados novamente para
que apenas a área de contagem permaneça.
Com o ultramicrótomo, serão obtidos 11 cortes “seriados” por fragmento
de tecido incluído em resina. Cada fatia deverá aproximadamente 85 nm de
espessura. Os 11 cortes serão colocados em telas de cobre (Fig.2)
cobertas com Formvar. Os cortes quando fotografados, formarão 10
dissectors por bloco, o que renderá um total de 30 dissectors por
animal, o que garantirá uma considerável variabilidade entre os campos.
Para visibilizar os contornos das sinapses, por meio de microscopia
eletrônica, os tecidos serão corados previamente em uranila e chumbo.

Fig. 2.
Representação do tecido sobre a tela de cobre. Está sendo representado
somente um corte sobre a tela, porém, serão colados 11 cortes os quais
deverão estar alinhados como uma tênia.
A espessura de 85 nm foi
escolhida com base nos estudos de Elias e colaboradores. Estes autores
investigaram o tamanho médio das sinapses através da visibilidade, por
meio de microscópio eletrônico, de 10 cortes seriados de um tecido
cerebral. Os tecidos foram fotografados e analisados em uma magnitude
primária de 10.000X, de onde obtevem-se cortes com aproximadamente 85 nm
em serie seria a ideal para conter as sinapses a serem analisadas (Elias
et al., 1983).
O exame do material será realizado através do Microscópio Eletrônico de
Transmissão (JEOL - JEM-1200 EXII). Para fotografar nós utilizamos uma
emissão de elétrons de 80,0kV e a magnitude de 5.000X. Serão
fotografadas as mesmas áreas nas 11 fatias de tecido. Quando da
revelação do negativo, o aumento de 3X é suficiente, perfazendo um
aumento final de 15,000X, de onde procedemos a contagem das sinapses. O
material geralmente é revelado em papel Kodabrome Print F3 (18 x 24cm).
Com as fotografias em mãos será utilizado o método de dissector para
contagem das sinapses (Sterio, 1984; Granados-Rojas et al., 2002). O princípio
do dissector diz que: se o perfil de uma partícula aparecer em um plano
do dissector e não aparecer no plano seguinte, ele representará uma
partícula e será contado. Esse método também
impõe a
utilização do sistema teste de moldura de contagem sobre as fotografias
para impedir que o mesmo perfil sináptico seja contado duas
vezes.
Ex.: Ilustração dos dissectors. O plano 1 será comparado com o plano 2,
este com o plano 3, e assim sucessivamente.
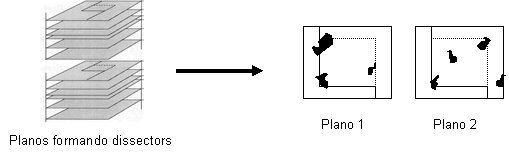
O sistema de moldura é formado por linha proibida (linha continua) e por
linha permitida (linha pontilhada). Os perfis contáveis deverão estar
dentro da moldura ou tocando a sua linha permitida, desde que não passe
pela linha proibida. Dessa forma, deve-se obedecer a regra do dissector
que diz que o perfil só é contável quando aparece no primeiro plano e
não aparece no segundo.
O número total de sinapses
será determinado com base na densidade numérica da sinapse assimétrica e
no volume total de referência. Nesse sentido, estimaremos
o
número de sinapses por unidade de volume (densidade numérica =
Nv)
e multiplicaremos esse parâmetro pelo volume de referência
V(referência).
Esses dois cálculos estão exemplificados a seguir.
Nsinapses = V(referência)
x Nv
Ex.:
Estimação do volume da camada molecular do giro denteado de acordo com o
principio de Cavalieri
A formação hipocampal de
um rato será inteiramente seccionada, em sentido coronal, em fatias de
30 µm, através do criostato (Leica CM 1850). Serão tomadas amostras
sistemáticas uniformes a cada 10 cortes, sendo que o primeiro corte foi
escolhido aleatoriamente. Ao todo foram recolhidas 11 fatias para a
estimação do volume da camada molecular do giro denteado. A distância
entre cortes ou espessura ( T ) foi de 300 µm. Estas amostras serão
dispostas em lâminas, tomando-se sempre o cuidado de voltar para cima o
lado que recebeu o primeiro corte, e coradas com cresil violeta para
possibilitar uma melhor visualização dos limites do hipocampo.
Posteriormente, as imagens do hipocampo serão capturadas por um
microscópio acoplado a um terminal de computador, e terão suas imagens
impressas num aumento de 20X do tamanho original. Um sistema teste de
pontos será sobreposto ao acaso sobre as 11 fatias.
Para o cálculo do volume da camada molecular do giro denteado, através
do princípio de Cavalieri, dispomos da seguinte fórmula:
V := T . (a/p) . ∑P
Donde V é o volume a ser
calculado; T é a espessura da fatia obtida; a/p é a área associada com
cada ponto no sistema teste utilizado e ∑P é o número total de
pontos obtidos nas fatias analisadas (Gundersen & Jensen, 1987, Michel &
Cruz-Orive, 1988).
Tomar-se-á o cuidado em corrigir a retração tecidual da área analisada,
para isso, efetuaremos os cálculos com base na fórmula (Van Aden &
Uylings, 1985):
V(referência)corrigido
= V(referência) x (1 - retração)
Donde:
V = volume
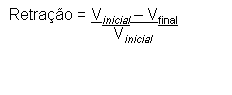
Estimação
da densidade numérica da sinapse da camada molecular do giro denteado:
Após contar as sinapses, respeitando a regra do dissector,
correlaciona-se as mesmas ao volume em que estão inseridas. Para isso,
aplica-se a seguinte fórmula:

Donde NV é a
densidade numérica; (a/f) é a área associada a cada moldura; h é a
distância entre cortes analisados; ∑P é a somatória do número de
pontos, do sistema teste de pontos, associados a moldura, que atingem o
espaço de referência; ∑Q- é o número de perfis
amostrados pela moldura de amostragem no plano de referência e que não
são vistos no plano de análise.
Provavelmente os dados serão avaliados através do programa ANOVA.
|